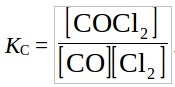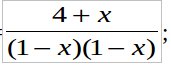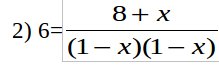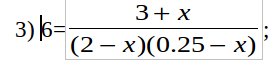Задания по химии. 9 класс
Задача 1. Закончить уравнения реакций и расставить коэффициенты
- PCl5 + SO2 → ;
- SO2 + Cl2 →;
- SO3 + HCl →;
- H2SO4(конц.) + PCl5 →;
- SeCl2 + H2O →;
- As2S3 + HNO3 →;
- FeS2 + HNO3 →;
- Zn + NH3 + NH4Cl →;
- Na2SO4 + C + CaCO3 →;
- Pb3O4 + NaClO →;
Решение.
1) PCl5 + SO2 → SOCl2 + POCl3; реакция обмена
2) SO2 + Cl2 →SO2Cl2; окислительно-восстановительная реакция
(расстановку коэффициентов удобно выполнить методом электронного баланса)
S+4 — 2ē → S+6;
Cl20 + 2ē → 2Cl-1.
3) SO3 + HCl → HSO3Cl; реакция обмена
4) H2SO4(конц.) + PCl5 → HSO3Cl + HCl + POCl3; реакция обмена
5) 2SeCl2 + 3H2O H2SeO3 + Se + 4HCl; окислительно-восстановительная реакция
(расстановку коэффициентов удобно выполнить методом полуреакций)
SeCl2 + 3H2O — 2ē →SeO32— + 6H+ + 2Cl—;
SeCl2 + 2ē →Se0 + 2Cl—.
6) 2As2S3 + 28HNO3 → 6H3AsO4 + 9H2SO4 + 28NO↑; окислительно-восстановительная реакция
(расстановку коэффициентов удобно выполнить методом электронного баланса)
2As+3 — 4ē→ 2As+5;
3S-2 — 24ē→ 3S+6; (итого, суммарное число электронов, принимающих участие в стадии окисления 4 + 24 = 28)
N+5 + 3ē→ N+2.
7) 2FeS2 + 10HNO3 → Fe2(SO4)3 + H2SO4 + 10NO↑ + 4H2O; (напомним, что в пирите FeS2 железо имеет степень окисления +2) окислительно-восстановительная реакция
(расстановку коэффициентов удобно выполнить методом полуреакций)
FeS2 + 8H2O — 15ē → Fe3+ + 2SO42- + 16H+;
NO3— +4H+ + 3ē → NO + 2H2O.
8) Zn + 2NH3 + 2NH4Cl → [Zn(NH3)4]Cl2 + H2↑
окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом электронного баланса)
Zn0— 2ē → Zn+2;
2H+ + 2ē → H20.
9) Na2SO4 + 2C + CaCO3 Na2CO3 + CaS + 2CO2↑ (метод Леблана – метод получения карбоната натрия из сульфата натрия) ;
окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом электронного баланса)
С0— 4ē → С+4;
S+6 + 8ē → S-2.
10) Pb3O4 + 2NaClO → 3PbO2 + 2NaCl; (напомним, что сурик Pb3O4 является ортоплюмбатом свинца Pb2+2Pb+4O4 )
окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом электронного баланса)
Pb+2— 2ē → Pb+4;
Cl+1 + 2ē → Cl-1.
Задача 2. Реактив А, представляющий из себя крупные комки белого или серого цвета, имеет на редкость отвратительный запах и состоит из элементов Х и У в массовом соотношении 1:1.78 соответственно. Взаимодействие этого вещества с раствором соляной кислоты приводит к выделению бинарного (двухэлементного) газа В, обладающего кислыми свойствами и содержащего 94.1% (масс.) элемента У.
1) Установите элементы Х и У, соединения А и В, напишите уравнение реакции А с соляной кислотой. 2) Объясните, почему вещество А так плохо пахнет. Как в химической литературе обычно называют этот запах? 3) Как Вы думаете, почему производители выпускают вещество А в виде комков, а не размалывают в порошок, как большинство других реактивов? 4) Как соединение А будет реагировать с избытками следующих веществ: а) раствором гидроксида натрия; б) горячей концентрированной азотной кислотой; в) хлорной водой; г) горячим газообразным хлором; д) иодной водой? Напишите уравнения реакций.
Решение.
1. Бинарный газ В обладает кислыми свойствами, получается при реакции с кислотой и содержит очень легкий элемент (94.1% (масс.) У) – все к тому, что один элемент в его составе – водород.
Запишем формулу В как НnУ, тогда 1•n/МВ=(100-94.1)/100, откуда МВ/n=17. При n=2 получаем, что У – сера, а В – H2S.
Значит А – какой-то сульфид с брутто-формулой М2Sn.
Из условия 32n/2M=1.78, откуда M/n = 9 — подходит алюминий (27/3) (Be, Sc, Cu, Ge – не проходят по валентностям).
Итак, Х – Al, А – Al2S3.
Al2S3+ 6HCl → 2AlCl3+ 3H2S↑.
2. Сульфид алюминия – соль очень слабых кислоты и основания, на воздухе гидролизуется содержащимися в нем парами воды с выделением газа, имеющего запах тухлых яиц:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑.
3. Чем больше комки, т.е. меньше поверхность реактива, тем меньше скорость процесса, описанного в п.2; в порошке сульфид алюминия будет портиться значительно быстрее.
4. Реакции Al2S3:
а) Al2S3+ 8NaOH → 2Na[Al(OH)4] + 3Na2S;
б) Al2S3+ 24HNO3 → Al2(SO4)3+ 24NO2↑ + 12H2O;
в) Al2S3+ 12Cl2+ 12H2O → Al2(SO4)3+ 24HCl;
г) 2Al2S3+ 9Cl2 → 4AlCl3+ 3S2Cl2;
д) Al2S3+ 3I2(aq.) →2AlI3+ 3S↓.
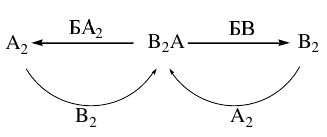
Задача 3. Элементы А, Б, В находятся в разных периодах таблицы Менделеева и образуют соединения Б2А, БА2, В2А и БВ. При взаимодействии БВ с В2А выделяется газ В2, а при взаимодействии БА2 с В2А образуется газ А2, который, реагируя с В2, снова образует В2А (см. схему):
Также известно, что молярная масса Б2А в 1.324 раза больше молярной массы БА2. Определите неизвестные элементы и напишите уравнения всех реакций, описанных в задаче. Какие Вы еще знаете вещества, образованные из атомов только этих трех элементов (простые, бинарные, трехэлементные)? Напишите уравнения реакций взаимодействия БА2 и В2А, БВ и А2, БА2 и CO2. Где применяется вещество БА2, как его можно получить?
Решение.
1. Определение элементов можно выполнить несколькими способами.
Первый способ. Выбор элементов, образующих газообразные соединения А2 и В2, достаточно ограничен: H2, N2, O2, F2, Cl2. Из них напрямую с образованием соединения В2А реагируют только кислород и водород. Кислород просматривается и из состава соединений БА2 и Б2А.
Элемент Б находится из соотношения молярных масс: (2·МБ+16)/(2·16+МБ) = 1.324, откуда МБ = 39. Итак, А – кислород, Б – калий, В – водород.
Второй способ. Можно пойти более строгим путем и сразу составить уравнение: (2·МБ+МА)/(2·МА+МБ)=1.324, откуда МБ=2.438·МА. Затем небольшим перебором атомных масс элемента А (с учетом двухатомности и газообразности простого вещества) можно получить, что так соотносятся только массы кислорода и калия.
2. Уравнения реакций:
KH + H2O → KOH + H2↑, Н2 – это газ В2 на схеме;
4KO2 + 2H2O 4KOH + 3O2↑, О2 – это газ А2 на схеме;
2H2 + O2 → 2H2O, Н2О – это вещество В2А на схеме.
3. Вещества, состоящие из К, О и Н: O3, K, H2O2, K2O2, KO3, KOH, КН.
4. K2O + H2O → 2KOH;
2KH + O2 → 2KOH;
4KO2+ 2CO2 → 2K2CO2+ 3O2↑.
5. KO2 применяется для регенерации кислорода из углекислого газа, например, на подводных лодках или в изолирующих противогазах. Надпероксид калия – основной продукт, образующийся при сгорании калия в кислороде: K + O2 → KO2.
Задача 4. Чем объяснить склонность серы к образованию цепных молекул и почему это малохарактерно для кислорода? В каких условиях могут существовать двухатомные молекулы кислорода, серы, селена и теллура?
Решение:
Вследствие большей величины атомного радиуса серы pπ-pπ перекрывание между её атомами существенно меньше по сравнению с атомами кислорода, что приводит к резкому снижению устойчивости кратных связей S=S. Напротив, у элементов второго периода (в том числе и у кислорода) склонность к образованию кратных связей выражена достаточно сильно (-С≡С-, -С=С-, -N≡N-, -N=N-, O=O, >C=O, –N=O, -C≡N, >C=N- и т.д.).
Меньшее содержание атомов в молекуле кислорода О2, чем в молекуле S8 или Se8, объясняется очень малым размером его атомов и вытекающим отсюда чрезвычайно сильным межэлектронным отталкиванием, делающим непрочной одинарную связь О-О. Напротив, прочной оказывается кратная (двойная) связь О=О. Это связано, как уже отмечалось, с сильным pπ-pπ перекрыванием, характерным для элементов неметаллов, имеющих самые маленькие размеры атомов (O, N, C). Уменьшение числа атомов в молекуле при переходе к Te и Ро происходит по той же причине, и связано с усилением металлических свойств: с ростом радиуса атомов прочность любых, даже одинарных ковалентных связей падает.
Таким образом, у атомов серы проявляется склонность к образованию двух σ-связей, что ведет к образованию цепей -S-S-. Вместе с тем известно, что связь -S-S- более прочная (ЕS-S ≈213 кДж/моль) по сравнению со связью -О-О- (ЕО-О≈138 кДж/моль), что, по всей вероятности, указывает на то, что связь -S-S- не чисто одинарная. Упрочнение связи между атомами серы в цепи -S-S- возможно за счет дополнительного перекрывания pπ-dπ по дативному механизму.
Кислород имеет молекулярную структуру (молекула О2) во всех трех агрегатных состояниях. Молекулы серы, селена и теллура состава Э2 образуются лишь в газообразном состоянии при достаточно высоких температурах. При понижении температуры идут процессы конденсации. Например,
4S2(газ) → S8(газ);
S8(газ) → S(ромб.).
Задача 5. Сколько времени надо производить электролиз для полного выделения никеля из 80 мл 2%-ного раствора NiSO4 ·7H2O, плотность которого 1.01 г/мл, током 0.28 А при выходе по току 90%?
Решение:
1. Определим содержание ионов Ni2+ в данном растворе.
Масса 80 мл 2%-ного раствора NiSO4·7H2O равна 80 мл·1.01 г/мл=80.8 г.
100 г раствора NiSO4·7H2O содержат 2 г кристаллогидрата,
80.8 г раствора NiSO4·7H2O содержат x1 г кристаллогидрата,
отсюда x1=1.616 г.
281 г NiSO4·7H2O 59 г никеля,
1.616 г NiSO4·7H2O содержат x2 г никеля,
отсюда x2=0.339 г или 0.0057 моль.
Выход по току это отношение массы фактически выделенного вещества к массе вещества, которая должна быть выделена в соответствии с законом Фарадея:
η (%) = (mпрактmтеорет)·100%.
Отсюда, 0.339 г – это фактическая масса Ni, которая должна быть выделена из раствора, тогда mтеорет = 0.339 г/0.9=0.377 г или 0.0064 моль.
2. Составим уравнение катодного процесса, в результате которого на катоде выделяется никель. При этом заметим, что в результате электролиза водного раствора сульфата никеля (II) на катоде выделяется металлический никель. Аналогичный продукт выделяется также при электролизе хлорида и бромида никеля (II). Вместе с тем, при электролизе нитрата, гидроксида и некоторых других соединений никеля (II) на катоде образуется водород, а на аноде NiO(OH) – метагидроксид никеля (нерастворим в воде и с течением времени при комнатной температуре «стареет»: 2NiO(OH)+H2O→Ni2О(ОН)4)
Итак, на катоде: Ni2+ + 2ē → Ni0.
Согласно уравнению катодного процесса на выделение 1 моль Ni затрачивается 2 моль ē. Таким образом, количество электронов, прошедших через раствор равно:
0.0064·2=0.0128 моль
По закону Фарадея находим необходимое время электролиза:
n(ē)=I·t/F, t= n(ē)·F/I,
t=0.0128 моль·96500 (Кл/моль)/0.28 (А)=4411 сек. или 1.225 часа.
Ответ: t=4411 сек. или 1.225 часа.
Задача 6. Прокалили смесь, состоящую из 48 г диоксида кремния и 57.6 г магния. При обработке полученной массы раствором соляной кислоты выделилось 7.95 л водорода (p=2 атм, t=50ºС). Написать уравнения протекающих реакций и определить количество образовавшегося кремния.
Решение: Диоксид кремния реагирует с магнием по уравнению:
SiO2 + 2Mg → Si + 2 MgO. (1)
Из уравнения реакции (1) видно, что магний берется в избытке (масса избытка Mg составляет 19.2 г). Поэтому образовавшийся кремний реагирует с магнием с образованием силицида магния по следующему уравнению:
Si + 2Mg → Mg2Si. (2)
Оставшийся магний будет реагировать с соляной кислотой с выделением водорода по уравнению:
Mg + 2HCl → MgCl2 + H2. (3)
С соляной кислотой реагируют также оксид магния и силицид магния по следующим уравнениям:
MgO + 2HCl → MgCl2 + H2O, (4)
Mg2Si + 4HCl → 2MgCl2 + SiH4↑. (5)
Рассмотрим несколько способов решения.
1-й способ.
Из уравнения реакции (1) видно, что
60 г SiO2 реагируют с 48 г Mg
48 г SiO2 реагируют с х1 г Mg
отсюда х1 = (48·48)/60=38.4 г.
Из уравнения реакции (3) видно, что
22.40 л Н2 вытесняются 24 г Mg,
13.44 л Н2 вытесняются x2 г Mg,
(для определения объема Н2 воспользовались уравнением состояния идеального газа:
(p1·V1)/T1=(p2·V2)/T2; (Т(К)=t(ºС) + 273); V2(н.у.)=(p1·V1·Т2)/(p2·Т1)=(2 атм·7.95 л·273 К)/(1 атм·323 К); V2=13.44 л)
отсюда x2 = (13.44·24)/22.4=14.4 г.
Значит, из 57.6 г взятого магния 38.4 г прореагировали с диоксидом магния, 14.4 г – с соляной кислотой, а оставшиеся 4.8 г (57.6 – 38.4 — 14.4 = 4.8) вступили в реакцию с образовавшимся кремнием. Из уравнения реакции (1) видно, что
из 60 г SiO2 образуется 28 г Si, из 48 г SiO2 образуется x3 г Si,
отсюда x3 = (28·48)/60=22.4 г.
Из уравнения реакции (2) видно, что
48 г Mg реагируют с 28 г Si, 4.8 г Mg реагируют с х4 г Si,
отсюда x4 = (284.8)48=2.8 г.
Таким образом, из 22.4 г образовавшегося в ходе реакции кремния 2.8 г прореагирует с магнием, а 19.6 г (22.4 г — 2.8 г = 19.6 г) останутся.
2-й способ. По условию задачи смесь состояла из 48 г, или 0.8 моль (48/60=0.8), SiO2 и 57.6 г, или 2.4 моль (57.6/24=2.4), Mg. При обработке сплава раствором соляной кислоты выделилось 13.44 л (н.у.) (для определения объема Н2 воспользовались уравнением состояния идеального газа: (p1·V1)/T1=(p2·V2)⁄T2; V2(н.у.)=(p1·V1·Т2)/(p2·Т1) = (2 атм·7.95 л·273 К)/(1 атм·323 К); V=13.44 л), или 0.6 моль (13.44/22.4=0.6), водорода. Из уравнения реакции (3) видно, что 0.6 моль водорода может выделиться, если прореагирует 0.6 моль магния. Из уравнения (1) видно, что 1 моль SiO2 реагирует с 2 молями Mg, а 0.8 моль SiO2 реагируют с 1.6 моля Mg с образованием 0.8 моль Si. Значит, 2.4 моль взятого Mg 1.6 моля прореагировало с SiO2, 0.6 моль – с соляной кислотой, а остальные 0.2 моль Mg реагируют с 0.1 моля Si. Таким образом, из 0.8 моль образовавшегося Si 0.1 моля реагирует с Mg, а остальные 0.7 моля (0.8-0.1=0.7) или 19.6 г (0.7·28=19.6), останутся.
Ответ: m(Si)=19.6 г.
Задача 7. Константа равновесия Кс реакции
СО(газ) + Cl2(газ) COCl2(газ)
при некоторой температуре равна 6. В каком направлении будет протекать реакция при следующих исходных количествах реагирующих веществ:
- 1 моль СО, 1 моль Cl2, 4 моль COCl2;
- 1 моль СО, 1 моль Cl2, 8 моль СОCl2;
- 2 моль СО, 0.25 моль Cl2, 3 моль COCl2.
Решение: Допустим, что в каждом случае возможно смещение равновесия. Рассчитаем количество прореагировавших компонентов, выраженное через х. Так как соотношение количеств молей газообразных веществ пропорционально соотношению их концентраций, можно использовать последние, подставляя их в выражение для константы равновесия (можно также предположить, что объем реакционного сосуда постоянен и равен 1 л, тогда исходные количества вещества в молях становятся равными молярной концентрации):
Из уравнения реакции следует, что если прореагировало х моль оксида углерода и х моль хлора, то образуется х моль фосгена. Тогда в каждом из случаев равновесные концентрации равны:
1) [CO]=1-x, [Cl2]=1-x, [COCl2]=4+x;
2) [CO]=1-x, [Cl2]=1-x, [COCl2]=8+x;
3) [CO]=2-x, [Cl2]=0.25-x, [COCl2]=3+x.
Отсюда следует:
решая полученное квадратное уравнение получаем х=0.16.
Число молей участников реакции в момент достижения равновесия: [CO]=0.84 моль, [Cl2]=0.84 моль, [COCl2]=4.16 моль.
Т.к. количество вступившего в реакцию СО (или Cl2) положительно, то это означает, что реакция в смеси будет идти в сторону образования фосгена, т.е. равновесие смешено вправо (в сторону образования продуктов реакции).
решая полученное квадратное уравнение получаем х=-0.15.
Число молей участников реакции в момент достижения равновесия: [CO]=1.15 моль, [Cl2]=1.15 моль, [COCl2]=7.85 моль.
Т.к. количество вступившего в реакцию СО (или Cl2) отрицательно, то это означает, что реакция в смеси будет идти в сторону разложения фосгена, т.е. равновесие смешено влево (в сторону распада продуктов реакции).
решая полученное квадратное уравнение получаем х=0.
Число молей участников реакции в момент достижения равновесия равно исходным: [CO]=2 моль, [Cl2]=0.25 моль, [COCl2]=3 моль.
Т.к. количество вступившего в реакцию СО (или Cl2) равно нулю, то это означает, что реакция достигла состояния равновесия.
Ответ: 1) [CO]=0.84 моль, [Cl2]=0.84 моль, [COCl2]=4.16 моль, равновесие смешено вправо; 2) [CO]=1.15 моль, [Cl2]=1.15 моль, [COCl2]=7.85 моль, равновесие смещено влево; 3) [CO]=2 моль, [Cl2]=0.25 моль, [COCl2]=3 моль, состояние равновесия.