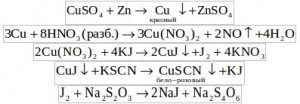Задания по химии для 10 класса
Задача 1. Для анализа на содержание примеси тяжелого металла из гальванической ванны в колбу вместимостью 250.00 мл отобрали пипеткой 50.00 мл электролита цинкования. Отобранную пробу подкислили серной кислотой и добавили металлический цинк. Полученный красный осадок промыли и растворили в избытке разбавленной азотной кислоты, который затем удалили из пробы выпариванием. После этого к пробе прилили избыток реактива Брунса (смесь KJ и KSCN) и оттитровали 3.45 мл 0.103 М раствора NA2S2O3 до появления бело-розового мутного раствора (цвет слоновой кости). Определите содержание (в г/л) тяжелого металла в электролите? Составьте уравнения реакций, описывающие ход анализа.
Решение: Определяемым металлом является медь. Запишем уравнения реакций, описывающих данный анализ:
Здесь ты найдешь уроки, исследования, интересные факты и вдохновение для творчества.
Число эквивалентов меди можно записать через отношение массы меди к молярной массе эквивалента меди: ![]()
а число эквивалентов Nа2S2O3 через молярную концентрацию эквивалента и объем раствора Nа2S2O3 (поскольку фактор эквивалентности для Nа2S2O3 равен 1, то молярная концентрация раствора Nа2S2O3 численно равна молярной концентрации эквивалента):
Подставляем уравнения (2) и (3) в уравнение (1) и находим массу меди:![]()
Вычисленная масса меди содержится в 50 мл электролита, соответственно в 1 л электролита:
m(Cu) = 0.02274 · 20 = 0.4548 (г)
Ответ: c(Cu) = 0.4548 г/л
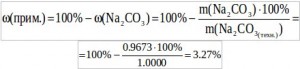
Задача 2. Навеску технического карбоната натрия массой 1.0000 г растворили в мерной колбе вместимостью 250.00 мл. На титрование аликвотной части полученного раствора (10 мл) в присутствии индикатора метилового оранжевого (индикатор изменяет свою окраску в интервале концентраций H+ от 10-4 до 10-3 моль/л) израсходовано 7.30 мл 0.1000 М раствора HCl. Вычислите массовую долю примесей в образце?
Решение: Поскольку титрование идет в присутствии индикатора метилового оранжевого, изменяющего свою окраску в кислой среде, то реакция между Na2Co3 и HCl проходит по 2-м ступеням до угольной кислоты:
Na2Co3 + 2HCl →2NaCl + H2Co3
Запишем закон эквивалентов для данной реакции:
![]() Число эквивалентов Na2Co3 можно представить через отношение массы карбоната к его молярной массе эквивалента:
Число эквивалентов Na2Co3 можно представить через отношение массы карбоната к его молярной массе эквивалента:
![]() а число эквивалентов HCl через молярную концентрацию эквивалента и объем раствора HCl:
а число эквивалентов HCl через молярную концентрацию эквивалента и объем раствора HCl:
![]() Подставляем уравнения (2) и (3) в уравнение (1) и учитывая, что титруется не весь раствор, а только его часть, получаем:
Подставляем уравнения (2) и (3) в уравнение (1) и учитывая, что титруется не весь раствор, а только его часть, получаем:
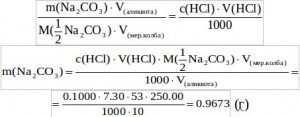 Найдем массовую долю примесей:
Найдем массовую долю примесей:
Задача 3. Для определения содержания фенола в очищенных промышленных стоках используют метод кулонометрического титрования на платиновых электродах по реакции бромирования. Для проведения анализа 100.00 мл пробы подкислили и ввели избыток KBr. Определите содержание фенола в сточной воде (в мкг/мл), если на титрование при силе тока 0.0515 А было затрачено 7 мин 35 с.
Решение: Метод кулонометрического титрования фенола основан на генерации Br2 при электролизе KBr на платиновом электроде с последующей реакцией Br2 с фенолом с образованием трибромфенола по уравнению: ![]()
Запишем уравнение реакции генерации Br2 из KBr на платиновом электроде: ![]()
Рассчитаем массу фенола в 100 мл пробы по закону Фарадея:
![]() Соответственно сточная вода содержит 38 мкг/мл.
Соответственно сточная вода содержит 38 мкг/мл.
Ответ: 38 мкг/мл
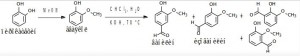
Задача 4. В плодах лианы Vanilla planifolia, паразитирующей на какао, ванилин содержится в виде соединений, не имеющих запаха. Постепенно при ферментации из стручков начинает высвобождаться душистый ванилин и стручки становятся коммерческой пряностью. Длительность обработки плодов привела к необходимости поиска синтетического ванилина. Ванилин имеет несколько изомеров, однако, запахом обладает только приведенный ниже.
Предложите схему синтеза ванилина исходя из пирокатехина. Напишите все изомеры ванилина. 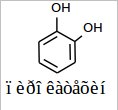
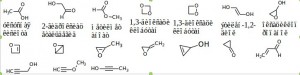
Задание 5. Постройте структурные формулы изомеров (не менее 5), отвечающих молекулярным формулам: а)С2H4O2; б)С3H4O. Назовите вещества в задании 10.а.
Решение:
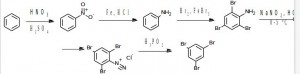
Задача 6. Предложите метод синтеза 1,3,5-трибромбензола из бензола.
Решение: Нельзя бромировать непосредственно цикл бензола, потому что первый введенный атом брома может ориентировать в другие орто- и пара-.
Задача 7. На складе химических реактивов нашли три бутылки, этикетки которых упали. На них можно прочитать соответственно: 1,2-дихлорбензол, 1,3-дихлорбензол, 1,4-дихлорбензол. Можем предположить, что хлорирование до трихлорпроизводных может разрешить эту загадку. Объясните, как с помощью реакции хлорирования дихлорбензолов до трихлорбензолов возможно различить содержимое бутылок. Объясните количество изомеров и назовите все изомеры.
Решение:
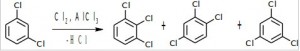
Первая бутылка.
При хлорировании 1,3-дихлорбензола получается 3 трихлорбензола:
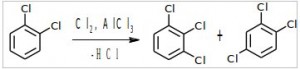
Вторая бутылка.
При дальнейшем хлорировании из 1,2-дихлорбензола получается только 2 изомера:
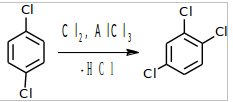
Третья бутылка.
При хлорировании 1,4-дихлорбензола, благодаря симметрии молекулы возможно образование только одного трихлорпроизводного.