Задания по химии для 11 класса
Задача 1. Определите интервал изменения окраски индикатора метилового оранжевого (ΔpH), считая: 1) метиловый оранжевый слабой одноосновной органической кислотой (HA) (Kдисс = 3.37 · 10-4); 2) глаз человека способен установить появление окрашенных частиц, если их содержание будет примерно в 10 раз или более превышать концентрацию других окрашенных частиц в растворе. (pH = -lg [H+])
Решение: По химической природе кислотно-основные индикаторы являются слабыми органическими кислотами или основаниями, частично диссоциирующими в растворе. Индикатор метиловый оранжевый является слабой одноосновной кислотой, поэтому для него в растворе справедливо равновесие:
HA ↔H+ + A— (1)
Равновесие (1) подчиняется закону действующих масс и количественно характеризуется константой диссоциации индикатора:![]()
Здесь ты найдешь уроки, исследования, интересные факты и вдохновение для творчества.
По теории ионных окрасок Оствальда недиссоциированные молекулы индикатора НА и аниона A— имеют разную окраску (для метилового оранжевого красную и желтую соответственно).
Выразим из уравнения (2) [H+]:
Найдем значение рН для раствора индикатора:
Принимая во внимание, что глаз человека способен установить появление окрашенных частиц, если их содержание будет примерно в 10 раз или более превышать концентрацию других окрашенных частиц в растворе, можно заключить, что красная окраска индикатора метилового оранжевого, обусловленная его недиссоциированными молекулами, будет наблюдаться в растворе в случае когда ![]() , а желтая окраска (обусловленная ионами A—) будет наблюдаться когда
, а желтая окраска (обусловленная ионами A—) будет наблюдаться когда ![]()
Уравнение (3) связывает интервал концентрационного отношения ![]() от 0.1 до 10 с интервалом рН, в котором происходит изменение окраски индикатора. Чтобы его найти, подставим предельные значения отношения
от 0.1 до 10 с интервалом рН, в котором происходит изменение окраски индикатора. Чтобы его найти, подставим предельные значения отношения ![]() , равные 0.1 и 10 в уравнение (3):
, равные 0.1 и 10 в уравнение (3): 
Ответ: ΔpH = 3.47 ± 1 или от 2.47 до 4.47 ед. рН
Задача 2. Растворили 1.3400 г пробы, содержащей KCl, KJ и инертный материал. Полученный раствор обработали избытком нитрата серебра. После фильтрования, промывания, высушивания масса осадка составила 1.047 г. Затем осадок нагрели в токе желто-зеленого газа, в результате чего масса осадка уменьшилась на 0.204 г. Рассчитайте массовые доли хлорида и иодида калия в пробе.
Решение: Запишем реакции, протекающие в ходе анализа:
![]() при этом масса осадков AgCl и AgJ составила 1.047 г.
при этом масса осадков AgCl и AgJ составила 1.047 г.
Затем осадок нагрели в токе Cl2 (желто-зеленый газ):
![]() и масса осадка стала 0.843 г (1.047-0.204).
и масса осадка стала 0.843 г (1.047-0.204).
Найдем массу AgCl, полученную при осаждении: 
По найденным массам AgCl и AgJ рассчитаем массы KCl и KJ в образце и их массовые доли: 
Ответ: ω (KCL) = 20.27%; ω (KJ) = 27.62%
Задача 3. Для контрольного анализа сплава Деварда, содержащего по массе 50% Cu, 45% Al и 5% Zn, взята навеска массой 0.5000 г. Сколько мл раствора NH4OH с массовой долей 1% и раствора NA2HPO4 с массовой долей 3% потребуется для осаждения цинка в виде смешанного фосфата? Плотность растворов принять равной 1.0 г/мл.
Решение: Определим массу Zn в навеске сплава, взятой на анализ:![]()
Составим уравнение реакции осаждения Zn и по нему рассчитаем массы NH4OH и NA2HPO4: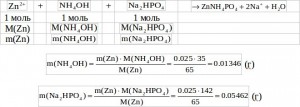
Определим массу раствора NH4OH и его объем:
т.к. плотность раствора равна 1 г/мл, то объем будет равен 1.35 мл.
Определим массу раствора NA2HPO4 и его объем: ![]()
т.к. плотность раствора равна 1 г/мл, то объем будет равен 1.82 мл.
Ответ: V(NH4OH) = 1.35 мл; V(Na2HPO4) = 1.82 мл
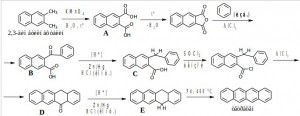
Задача 4. Тетрацен – полициклический ароматический углеводород; является органическим полупроводником, который используется в органических транзисторах и органических светодиодах. 
Из бензола, 2,3-диметилнафталина и неорганических реагентов получите тетрацен. Восстановите цепочку химических превращений. 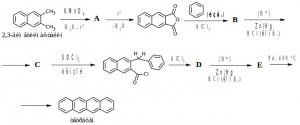
На первой стадии происходит окисление 2,3-диметилнафталина до дикарбоновой кислоты (A), затем дегидратация и образование ангидрида. На третьей стадии происходит реакция электрофильного замещения по Фриделю-Крафтсу в избытке бензола с образованием кето-кислоты (В). Затем восстановление (по Клемменсену) кетонной группы (С). Под действием хлористого тионила в среде бензола получен хлорангидрид карбоновой кислоты, который затем снова вводится во внутримолекулярную реакцию Фриделя-Крафтса, в результате образуется ароматический кетон (D). Снова происходит восстановление кетона по Клемменсену (E) и затем высокотемпературное дегидрирование на палладии.
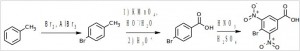
Задача 5. Исходя из толуола и других необходимых неароматических реагентов получите 3,5-динитро-4-бромбензойную кислоту (A) и продолжите цепочку превращений.
На первой стадии происходит бромирование по Фриделю-Крафтсу, затем окисление метильной группы. Далее проводится нитрование 4-бромбензойной кислоты (согласованная ориентация заместителей) (А).
Под действием хлористого тионила в среде бензола получен хлорангидрид карбоновой кислоты (B). Реакцией N-ацилирования хлорангидридом (B) анилина получен продукт (С) – 4-бром-3,5-динитро-N-фенилбензамид.
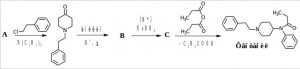
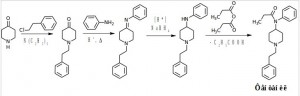
Задача 6. Органические соединения пиперидинового ряда являются сильными анальгетиками. Фентанил – самый сильный из известных анальгетиков пиперидинового ряда, его действие в 50 раз сильнее обезболивающего действия морфина. Восстановите цепочку синтеза фентанила.
Сначала проводят N-алкилирование кетона (A), затем получают имин (B) (основание Шиффа), который восстанавливают (C) и ацилируют пропионовым ангидридом — фентанил.