Олимпиадные задания по химии для 11 класса
1. Определите валентности и степени окисления элементов переходных металлов в следующих соединениях: А1. KMnO4, А2. K2MnO4. Напишите уравнение реакции, соответствующее схеме превращения А1 → А2.
Ответ: А1. Перманганат калия KMnO4: cтепень окисления марганца +7, валентность VII.
А2. Манганат калия K2MnO4: cтепень окисления марганца +6, валентность VI.
Реакции превращения:
2KMnO4(тв) ⎯⎯→ K2MnO4 + MnO2 + O2↑ при нагрев.
2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O.
2. При растворении 50 г сплава двух металлов в избытке водной щелочи максимально может выделиться 43,5 л (н.у.) водорода. При растворе-нии остатка в избытке соляной кислоты образуется зеленый раствор и выделяется еще 5,74 л H2. Определите состав сплава, ответ подтвердите расчетом. Как называется остаток, полученный при растворении сплава в щелочи, и для чего он используется в химической промышленности?
Здесь ты найдешь уроки, исследования, интересные факты и вдохновение для творчества.
Ответ: Один из металлов в сплаве – амфотерный (растворяется в щелочи) – возможно алюминий или цинк. Проверим цинк – рассчитаем его массу по количеству выделившегося водорода:
Zn + 2 NaOH + 2 H2O = Na2[Zn(OH)4] + H2
m(Zn) = (43,5/22,4) ×65,4 = 127 г
Итак цинк не подходит, поскольку его масса больше массы сплава. Проверим алюминий:
2 Al + 6 NaOH + 6 H2O = 2 Na3[Al(OH)6] + 3 H2
m(Al) = (43,5/22,4) ×2 / 3×27,0 = 35,0 г
Масса второго металла соответственно: 50 – 35 = 15 г.
Попробуем теперь определить молярную массу второго металла Met из уравнения его реакции с соляной кислотой:
Met + x HCl = MetClx + x / 2 H2 (x – валентность металла)
M(Met) = (15×2)/(x×5,74/22,4) = 117/x
Для двухвалентного металла (x = 2) имеются решения Co и Ni – у них близкие молекулярные массы. Однако именно соли никеля имеют зеленый цвет в водном растворе (при ответе кобальт). Образующийся после растворения в щелочи пористый Ni называют никелем Ренея и используют в качестве катализатора гидрирования.
3. В пробирках без подписей находятся растворы NaCl, Na2CO3, NaOH и NaNO3. Предложите способы определения содержимого пробирок. Напишите уравнения соответствующих реакций.
Ответ:
Данная задача может быть решена многими способами. Приведен один из возможных вариантов решения.
Ко всем растворам добавим соляную кислоту. Только в одном случае наблюдаются признаки реакции:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2 (выделяется бесцветный газ без запаха).
Реакция NaOH + HCl → NaCl + H2O протекает без видимых признаков. Таким образом, карбонат натрия определили.
При добавлении раствора нитрата серебра к веществам из трех оставшихся пробирок в двух случаях образуются осадки:
NaCl + AgNO3 → AgCl + NaNO3 (образуется белый творожистый осадок);
2NaOH + 2AgNO3 → Ag2O + 2NaNO3 + H2O (темно-коричневый осадок).
В последней пробирке находился нитрат натрия.
Подтвердим это реакцией с цинком в щелочной среде: NaNO3 + 4Zn + 7NaOH(конц) + 6H2O ⎯⎯→ 4Na2[Zn(OH)4] + NH3(выделяется газ с резким запахом – аммиак, окрашивающий лакмус в синий цвет).
4. Азот входит в состав двух соединений: N2X2Y4 и N2X3Y4. В первом соединении массовая доля азота равна 43.75%, а элемента Х – 50.0%. Установите неизвестные соединения и запишите уравнения их реакций с раствором щелочи.
Ответ: Поскольку в первом соединении два атома азота, можно рассчитать молярную массу этого вещества: М = 14 · 2 / 0.4375 = 64 г/моль.
Тогда масса X составляет М(X) = 64 · 0.50 / 2 = 16 г/моль – это кислород. М(Y) = (64 – 28 – 32) / 4 = 1 г/моль – это водород. Неизвестные соединения – нитрит аммония NH4NO2 и нитрат аммония NH4NO3.
Их реакции с раствором щелочи:
NH4NO2 + КOH → КNO2 + NH3↑ + H2O;
NH4NO3 + KOH → КNO3 + NH3↑ + H2O.
Ответ: NH4NO2 и NH4NO3
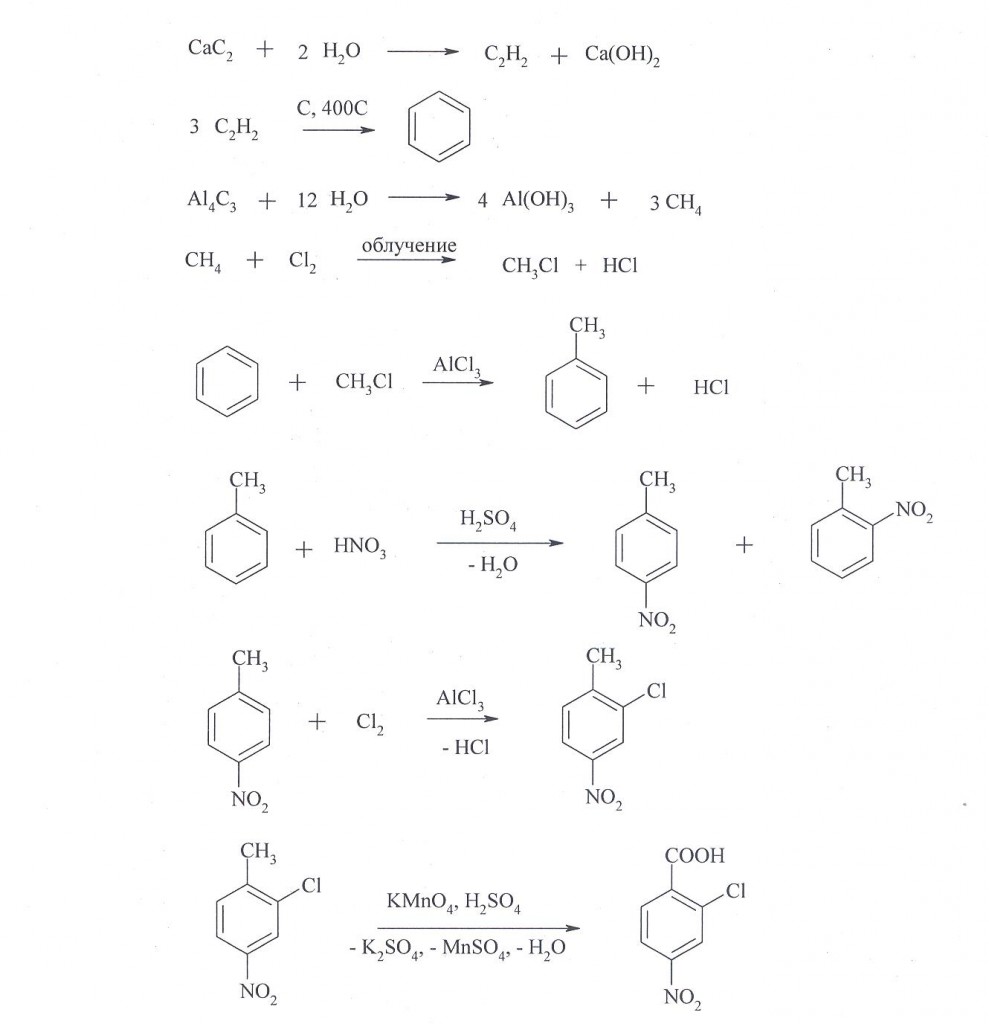
5. Предложите схему реакций, позволяющих получить 2-хлор-4-нитробензойную кислоту из неорганических веществ.