Химия. 10 класс
Задание 1. К какому типу принадлежат элементарные ячейки хлоридов натрия (NaCl) и таллия (TlCl) (кубическая или кубическая объемноцентрированная (см. рисунок)), если известно, что межъядерные расстояния Na-Cl и Tl-Cl по данным рентгеноструктурного анализа составляют 0,281 нм и 0,2714 нм, соответственно. Плотность хлорида натрия составляет 2,165 г/см3, а хлорида таллия 7,000 г/см3. Относительные атомные массы для Na, Tl и Cl равны 22,9898, 204,3833 и 35,4530, соответственно.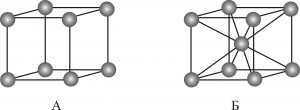
Решение. Одним из возможных алгоритмов решения задачи является расчет объема 1 моля солей на основе кристаллографических данных и сопоставление их данными, полученными другими методами.
Мольный объем вещества может быть рассчитан по формуле p=M/Vm, M – масса одного моля вещества (молярная масса, г/моль), Vm – объем одного моля вещества (мольный объем, см3/моль), p — плотность (г/см3). Из условий задачи следует, что Vm(NaCl) = 58,44282,165 = 26,99 см3, Vm(TlCl) = 239,83637,000 = 34,26 см3.
Расчет Vm(TlCl).
Здесь ты найдешь уроки, исследования, интересные факты и вдохновение для творчества.
1) Предположим, что элементарная ячейка TlCl имеет тип кубической объемноцентрированной решетки (ОЦК) (см. рис.1). Определим объем одной элементарной ячейки. ОЦК-тип решетки содержит одну формульную единицу TlCl (1 атом Tl в центре и 8 атомов Cl в вершинах куба, причем каждый из атомов Cl принадлежит ячейке на 18) (абсолютно аналогичный результат получаем, если атомы Tl и Cl поменять местами):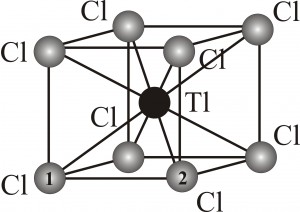
рис1.
Из рис.1. и свойств диагоналей куба следует, что угол Cl(1)TlCl(2) равен 90º, а значит треугольник с вершинами Cl(1), Tl и Cl(2) является прямоугольным и равнобедренным (длины связей Tl-Cl эквивалентны, а значит и равны). Отсюда по теореме Пифагора легко найти расстояние rCl-Cl: (rCl-Cl)2=2(rTl-Cl)2. В итоге, получаем:
(rCl—Cl)= rTl—Cl*=0,3838 нм.
Так как все стороны элементарной ячейки ОЦК равны, то её объем в случае TlCl равен: V(эл. яч.) = (0,3838)3 = 0,0565 нм3. Таким образом, одной формульной единице TlCl соответствует объем 0,0565 нм3. При умножении полученного результата на число Авогадро (NA=6,022*1023), получаем объем одного моля TlCl: Vm(TlCl) = 0,0565 нм3 * 6,022*1023 = 34,02*1021 нм3 = 34,02 см3
2) Предположим, что элементарная ячейка TlCl имеет тип простой кубической решетки (см. рис.2). Определим объем одной элементарной ячейки. Кубическая элементарная ячейка содержит четыре формульных единицы TlCl (1 атом Tl в центре, 12 атомов Tl на ребрах (каждый из таких атомов принадлежит ячейке на 1/4); 8 атомов Cl в вершинах куба (каждый из таких атомов Cl принадлежит ячейке на 1/8) и 6 атомов Cl на гранях куба (каждый из таких атомов Cl принадлежит ячейке на 1/2) (абсолютно аналогичный результат получаем, если атомы Tl и Cl поменять местами):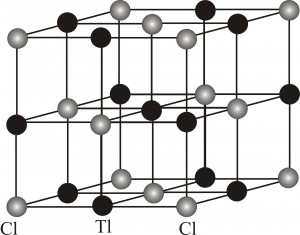
рис2.
Из рис.2 видно, что длина каждой стороны элементарной ячейки вдвое превышает величину межъядерного расстояния rTl-Cl. Поэтому объем элементарной ячейки в этом случае равен V(эл. яч.) = (2*rTl-Cl)3 = (2*0,2714)3 = 0,1599 нм3. Таким образом, четырем формульным единицам TlCl соответствует объем 0,1599 нм3. При умножении полученного результата на число Авогадро (NA=6,022*1023) и разделив полученный результат на 4, получаем объем одного моля TlCl: Vm(TlCl) = [0,1599 нм3 * 6,022*1023]/4 = 24,07*1021 нм3 = 24,07 см3.
Сопоставив значения мольного объема TlCl, рассчитанные в предположении различных типов элементарных ячеек с величиной Vm(TlCl) = 34,26 см3 можно заключить, что TlCl имеет кубическую объемноцентрированную элементарную ячейку.
Расчет Vm(NaCl).
Рассуждая абсолютно аналогично, для NaCl получаем:
Vm(NaCl) в случае кубической объемноцентрированной решетки равен 37,79 см3;
Vm(NaCl) в случае кубической решетки равен 26,72 см3;
Сопоставив значения мольного объема NaCl, рассчитанные в предположении различных типов элементарных ячеек с величиной Vm(TlCl) = 26,99 см3 можно заключить, что NaCl имеет кубическую элементарную ячейку.
Ответ: NaCl имеет кубическую элементарную ячейку; TlCl имеет кубическую объемноцентрированную элементарную ячейку
Задание 2. Жидкий углеводород А, обесцвечивающий бромную воду, при слабом нагревании над платиновым катализатором превращается в смесь углеводородов Б и В, не обесцвечивающих бромную воду. Назовите эти углеводороды и напишите уравнение реакции, если известно, что Б и В образуются в соотношении 2:1, а молярные массы А, Б, В относятся, соответственно, как 4,8:4,9:4,6. Назовите углеводород Г, который в тех же условиях образует Б и В в соотношении 1:2.
Решение: Из соотношения молярных масс следует, что происходит реакция диспропорционирования. Исходя из условий диспропорционирования и учитывая, что ни Б, ни В не обесцвечивают бромную воду, углеводород А – непредельный, Б – насыщенный, а В – ароматический.
Предположим, что В – моноциклическое соединение, тогда его формула CnH2n-6, а Б – насыщенный моноциклический углеводород, и его формула CnH2n.
МБ/МВ = (12n+2n)/(12n+2n-6) = 4,9/4,6
Откуда n=7. Значит, Б – С7Н14, В – С7Н8
Примем за x количество атомов Н, которых не хватает углеводороду А, чтобы превратится в предельный углеводород Б.
Тогда формула А имеет вид С7Н14-2x.
МА/МБ = (12n+2n-2х)/(12n+2n) = 4,8/4,9
МА/МВ = (12n+2n-2х)/(12n+2n-6) = 4,8/4,6
x = 1
3С7Н12 = 2С7Н14 + С7Н8
Таким образом, В – толуол, Б – метилциклогексан.
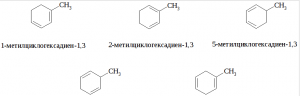
Углеводород А – смесь, либо один из изомерных метилциклогексенов: 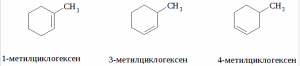
Если Б:В = 1:2, то рассуждая аналогично, получим, что А – смесь, либо один из изомерных метилциклогексадиенов:
3С7Н10 = С7Н14 + 2С7Н8
Задание 3. Объем газа, образовавшегося при полном разложении озона, больше объема, занимаемого чистым озоном на 4,48 л. Полученный после полного разложения озона газ смешали с 8,96 л сероводорода и сожгли, после чего продукты реакции растворили в 28,6 мл 40%-ного раствора гидроксида натрия (p=1,15 г/см3). Рассчитайте количество и состав полученной соли. Определите объем разложившегося озона.
Решение:
При разложении озона образуется кислород:
2O3 → 3O2. (1)
Из уравнения (1) видно, что при разложении 2 молей озона (44,8 л) образуется 3 моля кислорода (67,2 л), т.е. в соответствии с условием задачи при разложении 2 молей озона объем газа увеличился на 22,4 л, а при разложении х молей озона объем газа увеличился на 4,48 л. Составив пропорцию, получаем х(О3) = 0,4 моль, что соответствует 8,96 л озона.
Из уравнения (1) получаем, что объем образовавшегося О2 составляет 13,44 л.
При сжигании 8,96 л сероводорода в смеси с 13,44 л О2 получают 0,4 моля оксида серы (IV) и воду:
2H2S + 3O2 → 2SO2 + 2H2O. (2)
По условию задачи, имеется [28,6 (мл)*1,4 (г/мл) * 40 (г/моль)]/100 (г) = 16 г гидроксида натрия, что соответствует 0,4 молям. Полученный по уравнению (2) оксид серы (IV) с раствором NaOH может дать два типа солей:
NaOH + SO2 → NaHSO3. (3)
2NaOH + SO2 → Na2SO3 + H2O. (4)
Из представленных уравнений видно, что в реакции (3) компоненты взаимодействуют в соотношении 1:1, а в реакции (4) в соотношении 2:1. Из приведенных выше расчетов следует, что в реакцию вступило 0,4 моль NaOH и 0,4 моль SO2, а следовательно взаимодействие между ними протекает по уравнению (3), т.е. с образованием NaHSO3. Составив пропорцию, получаем, что количество образовавшейся соли (NaHSO3) составляет 41,6 г.
Ответ: m(NaHSO3) = 41,6 г; V(О3) = 8,96 л.
Задание 4. Газ, выделившийся при действии 3 г цинка на 18,69 мл 14,6%-ной соляной кислоты (p=1,07 г/см3), пропустили над 4 г оксида меди (II). Рассчитайте минимальный объем 19,6%-ного раствора серной кислоты (p=1,14 г/см3), необходимый для растворения избытка оксида меди и превращения оставшегося цинка. Какова масса восстановленной меди?
Решение:
Составим уравнения реакций:
- Zn + 2HCl → ZnCl2 + H2;
- CuO + H2 → Cu + H2O;
- CuO + H2SO4 → CuSO4 + H2O;
- Zn + H2SO4 →ZnSO4 + H2.
Определим массу хлороводорода (m1):
m1 = 1,07 (г/мл) * 18,69 (мл) * 0,146 = 2,92 г.
Определим соотношение реагентов в первой реакции:
n(Zn) = 3,0 (г) / 65 (г/моль) = 0,46 моль;
n(HCl) = 2,92 (г) / 36,5 (г/моль) = 0,08 моль.
Существует избыток цинка 0,006 моль, поэтому расчет ведем по HCl.
Определим количество вещества оксида меди, водорода:
n(CuO) = 4,0 (г) / 80 (г/моль) = 0,05 моль;
n(H2) = 0,5 n(HCl) = 0,04 моль.
Существует избыток оксида меди, равный 0,01 моль.
Определим выход меди (m2): m2 = 64 (г) * 0,04 (моль) = 2,56 г.
Определим число молей серной кислоты, необходимое для реакции с избытком оксида меди и цинка:
n1(H2SO4)=n(CuO)=0,01 моль;
n2(H2SO4)=n(Zn)=0,006 моль;
n1 + n2 = 0,016 моль.
Рассчитаем объем 19,6% раствора серной кислоты:
m(H2SO4) = 0,016 (моль) * 98 (г/моль) = 1,57 г;
m(раствора Н2SO4) = 1,57/0,196 = 8 г;
V(раствора Н2SO4) = m/p = 8 (г) / 1,14 (г/мл) = 7 мл.
Ответ: m(Cu) = 2,56 г; V(раствора Н2SO4) = 7 мл.
Задание 5. При действии Cl2 на некоторый углеводород обнаружили четыре хлорорганические вещества, являющиеся структурными изомерами и имеющие плотность по воздуху 3,672. Приведите структурные формулы углеводорода и четырех хлорорганических производных. Существуют ли у полученных хлорорганических производных пространственные изомеры? Ответ обоснуйте.
Решение:
Определяем молярную массу хлорпроизводного углеводорода СхНуСlz (где x,y,z-натуральные числа):
М = 29∙3,67 = 106,5 г/моль
Тогда 12х + у + 35,5z = 106,5
Поскольку значение молярной массы заканчивается на цифру 5, то в соединении нечетное число атомов хлора. Значение z не может быть больше одного, так как уже при z=3 получаем, что 12х + у + 35,5∙3 = 106,5
12х + у = 0, т. е x=y=0
Тогда 12х + у + 35,5 = 106,5
12х + у = 71
х = 5, у = 11
Таким образом, брутто-формула хлорпроизводного С5Н11Сl, а исходного углеводорода C5H12
Возможные структурные формулы для углеводорода :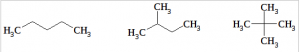
Только 2-метилбутан при хлорировании может дать 4 монохлорпроизводных, являющихся структурными изомерами (в случае 2,2-диметилпропана одно хлорпроизводное, а в случае н-бутана – три):
Каждое из соединений А и Б существуют в виде пространственных изомеров (энантиомеров), которые относятся друг к другу как предмет и зеркальное отражение. Оптическая изомерия обусловлена наличием асимметрического атома углерода (отмечен звездочкой):
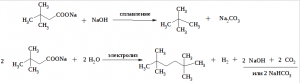
Задание 6. Какое строение имеет углеводород С10Н22, если известно, что он был получен электролизом водного раствора соли карбоновой кислоты, которая при сплавлении со щелочью образует 2,2-диметилпропан. Приведите уравнения реакций.
Решение: Углеводород С10H22 является 2,2,5,5-тетраметилгексаном.