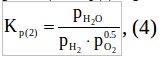Задания по химии для 9 класса
Задача 1. При количественном анализе доломита на его навеску массой 0.3967 г подействовали раствором органической кислоты, в результате чего был получен белый кристаллический осадок, который затем отфильтровали, промыли и растворили в серной кислоте. На титрование полученного раствора пошло 20.10 мл 0.04286 М раствора KMnO4. Определите массовые доли металлов в доломите. Составьте уравнения реакций, описывающие ход анализа.
Решение: Доломит представляет собой смесь карбонатов кальция и магния CaMg(CO3)2). Для разделения ионов Ca2+и Mg2+ используется щавелевая кислота (H2C2O4), поскольку СaC2O4 будет выпадать в осадок, а MgC2O4– нет (за счет образования растворимых комплексных ионов Mg(C2O4)2-2). Запишем уравнения реакций:
Запишем закон эквивалентов для всех реакций:
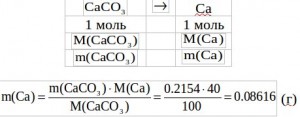
![]() Число эквивалентов CaCO3 можно представить через отношение массы карбоната к его молярной массе эквивалента:
Число эквивалентов CaCO3 можно представить через отношение массы карбоната к его молярной массе эквивалента:
Здесь ты найдешь уроки, исследования, интересные факты и вдохновение для творчества.
а число эквивалентов KMnO4 через молярную концентрацию эквивалента и объем раствора перманганата калия:
![]()
Подставляя уравнения (2) и (3) в уравнение (1), получаем:
![]() учитывая, что
учитывая, что
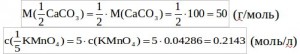 Находим массу CaCO3:
Находим массу CaCO3:
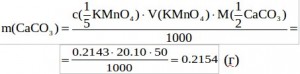 Зная массу CaCO3, сделаем пересчет на Са:
Зная массу CaCO3, сделаем пересчет на Са:
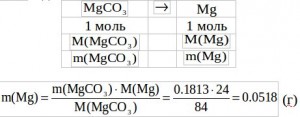
![]() Зная массу MgCO3, сделаем пересчет на Mg:
Зная массу MgCO3, сделаем пересчет на Mg:
и определим массовую долю Mg:
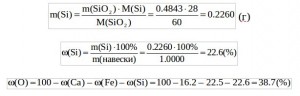
Задача 2. В образце лунного грунта обнаружен минерал, содержащий Ca, Fe, Si и О. Определите эмпирическую формулу минерала, если в результате гравиметрического анализа из навески минерала массой 1.0000 г было получено 0.2268 г СаО, 0.3214 г Fe2O3 и 0.4843 г SiO2.
Решение: Для того чтобы определить эмпирическую формулу минерала, необходимо сначала рассчитать массовые доли Ca, Fe, Si и О:
Найдем отношение мольных долей:
Ответ: Эмпирическая формула минерала – CaFeSi2O6
Задача 3. Закончить уравнения реакций и расставить коэффициенты:
- Cl2 + Ba(OH)2 → ;
- CaOCl2 + HCl →;
- Ca(ClO)2 + CO2 + H2O →;
- CaOCl2 + NaBr + HCl →;
- Cl2 + KI + KOH →;
- Cl2 + FeCl3 + NaOH →;
- H2O2 + As2S3 + NH4OH →;
- PCl5 + SO2→;
- Co(OH)2 + Br2 + NaOH →;
- P + NaOH + H2O →;
- NaClO3 + MnO2 + NaOH →;
- AuCl3 + AsH3 +KOH →;
- NaBiO3 + HCl(конц.) →;
- HClO4 + C →;
- Au + H2SeO4 →.
Решение:
1) 2Cl2 + 2Ba(OH)2 → BaCl2 + Ba(ClO)2 + 2H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
Cl2 + 2ē → 2Cl—;
Cl2 + 4OH— — 2ē → 2ClO— + 2H2O.
2) CaOCl2 + 2HCl → Cl2 + CaCl2 + H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
ClO— + 2H+ + 2ē → Cl— + H2O;
2Cl— — 2ē→ Cl2.
3) Ca(ClO)2 + CO2 + H2O → CaCO3 + 2HClO; реакция обмена
4) CaOCl2 + 2NaBr + 2HCl → CaCl2 + Br2 + 2NaCl + H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
ClO— + 2H+ + 2ē → Cl— + H2O;
2Br— — 2ē → Br2.
5) 3Cl2 + KI + 6KOH → 6KCl + KIO3 + 3H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
Cl2 + 2ē → 2Cl—;
I— + 6OH— — 6ē → IO3— + 3H2O.
6) 3Cl2 + 2FeCl3 + 16NaOH → 2Na2FeO4 + 12NaCl + 8H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
Cl2 + 2ē → 2Cl—;
Fe3+ + 8OH— -3ē → FeO42- + 4H2O
7) 14H2O2 + As2S3 + 12NH4OH → 2(NH4)3AsO4 + 3(NH4)2SO4 + 20H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
H2O2 + 2ē → 2OH—;
As2S3 + 40OH— -28ē → 2AsO43- + 3SO42- + 20H2O.
8) PCl5 + SO2 → SOCl2 + POCl3; реакция обмена
9) 2Co(OH)2 + Br2 + 2NaOH → 2Co(OH)3 + 2NaBr; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
Br2 + 2ē → 2Br—;
Co2+ — ē → Co3+.
10) 4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
P + 3H2O + 3ē → PH3 + 3OH—;
P + 2OH— -1ē → H2PO2—.
11) NaClO3 + 3MnO2 + 6NaOH → 3Na2MnO4 + NaCl + 3H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
ClO3— + 3H2O + 6ē → Cl— + 6OH—;
MnO2 + 4OH— — 2ē → MnO42- + 2H2O
12) 2AuCl3 + AsH3 +9KOH → 2Au + K3AsO3 +6KCl + 6H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
Au3+ + 3ē → Au0;
AsH3 + 9OH— – 6ē → AsO33- + H2O.
13) NaBiO3 + 6HCl(конц.) → BiCl3 + Cl2 + NaCl + 3H2O;
окислительно — восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
BiO3— + 6H+ +2ē → Bi3+ + 3H2O;
2Cl— — 2ē → Cl2.
14) возможно два варианта:
a) 4HClO4 + 7C → 2Cl2 + 7CO2 +2H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом электронного баланса)
Cl+7 + 7ē → Cl0;
C0 – 4ē → C+4.
б) HClO4 + 2C → HCl + 2CO2; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом электронного баланса)
Cl+7 + 8ē → Cl-1;
C0 – 4ē → C+4.
15) 2Au + 6H2SeO4 → Au2(SeO4)3 + + 3H2SeO3 + 3H2O; окислительно-восстановительная реакция (расстановку коэффициентов удобно выполнить методом полуреакций)
SeO42- + 2H+ + 2ē → SeO32- + H2O;
Au -3ē → Au3+.
Задача 4. Через 5 л 10%-ного раствора гидроксида натрия (ρ=1.109 г/см3) пропущен электрический ток. В результате концентрация раствора изменилась (увеличилась или уменьшилась?) на 3%. Какие вещества и в каких количествах выделились при этом на электродах?
Решение:
1) Запишем уравнение реакции электролиза:
NaOH + H2O → NaOH + 2H2 + O2.
Из уравнения реакции электролиза видно, что NaОН в результате электролиза не расходуется, а электролизу подвергается вода, т.е. её масса в растворе будет уменьшаться. Поэтому в результате электролиза раствора гидроксида натрия концентрация щелочи будет увеличиваться. Таким образом, концентрация раствора NaOH после электролиза составит 13%.
2) Рассчитаем массу раствора NaOH до электролиза:
m(NaOH(р-р 1)) = 5000 мл · 1.109 г/мл=5545 г.
3) Найдем массу NaOH в растворе:
m(NaOH) = (5545 г · 10%)/100% = 554.5 г.
4) Определим массу раствора NaOH после электролиза:
m(NaOH(р-р 2)) = (554.5 г · 100%) / 13% =4265.38 г.
5) Рассчитаем массу разложившейся в результате электролиза воды:
m(NaOH(р-р 1)) — m(NaOH(р-р 2)) = 1279.62 г.
6) По уравнению реакции электролиза рассчитаем массу выделившегося водорода и кислорода:
m(Н2) = (1279.62 (г) · 2 (моль) · 2 (г/моль))/ (2 моль · 18 (г/моль)) = 142.18 г.
m(О2) = (1279.62 (г) · 1 (моль) · 32 (г/моль))/ (2 моль · 18 (г/моль)) = 1137.44 г.
Ответ: m (H2) = 142.18 г; m (О2) = 1137.44 г.
Задача 5. Можно ли гидраты аргона и других инертных газов, например Ar·6H2O, Xe·6H2O и т.д., отнести к числу химических соединений? Как изменяется устойчивость записанных выше гидратов в ряду He — Xe? Можно ли использовать гидратообразование при разделении инертных газов? Ответы обоснуйте.
Решение: Клатраты, или соединения включения, состава Э·5.75Н2О, Э=Ar, Kr, Xe (обычно им приписывают формулу Э·6Н2О), представляют собой продукты физического включения атомов элементов в пустоты решетки льда. Состав Э·nН2О определяется соотношением количества включенных молекул и свободных полостей в кристаллической решетке льда. Устойчивость клатратов зависит в числе прочих факторов от размеров и формы внедренных молекул. Захваченные при кристаллизации льда молекулы (например, СН4) или атомы (например, Xe) взаимодействуют с молекулами воды за счет слабых межмолекулярных взаимодействий (дисперсионных сил), которых, однако, было бы недостаточно для образования комплекса, если бы не имел места эффект механического удерживания. Если молекулы очень малы по сравнению с пустотами в структуре льда, то они удерживаются слабо. Этим, в частности, объясняется отсутствие клатратов у Не и Ne, поскольку имея малые размеры их атомы имеют возможность диффундировать за пределы кристаллов льда. Прочность клатратов повышается, если размеры внедряемой частицы соответствуют размерам пустоты, образующейся между молекулами воды в решетке льда.
Итак:
гидраты Ar·6H2O, Xe·6H2O и т.д. не относятся к химическим соединениям;
в ряду He — Xe прочность клатратов увеличивается, причем для Не и Ne клатратообразование не наблюдается;
рассмотренное выше гидратообразование можно использовать для отделения легких благородных газов (Не и Ne) от тяжелых благородных газов (Ar, Kr, Xe).
Задача 6. Выразить константу равновесия реакции
N2(газ) + 3H2(газ) → 2NH3(газ)
через константы равновесия реакций:
N2(газ) + O2(газ) → 2NO (газ);
Н2(газ) + 1/2О2(газ) → Н2О (газ);
2NH3(газ) + 5/2О2(газ) → 2NO(газ) + 3Н2О(газ).
Решение:
1 способ:
Запишем константу равновесия исследуемой реакции:
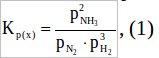
Константа равновесия для 1-ой реакции будет равна:
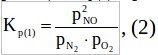
выразим из нее p2NO
![]()
Константа равновесия для 2-ой реакции будет равна:
выразим из нее ph2O: ![]()
Константа равновесия для 3-ей реакции равна: 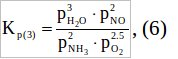
выразим из нее p2NH3: 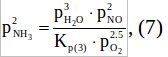
Подставим уравнение (5), возведенное в 3-ю степень в уравнение (7): 
Подставим уравнение (3) в (8):![]()
Подставим уравнение (9) в уравнение (1):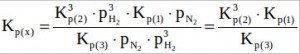
2 способ:
Запишем уравнение изотермы химической реакции для искомой реакции:
объединяя уравнения (1) и (2), получаем:
Задача 7. Константа равновесия КС реакции
СО(г) + Сl2(г) → СОСl2(г)
при некоторой температуре равна 6. В каком направлении будет протекать реакция при следующих исходных количествах реагирующих веществ:
1 моль СО, 1 моль Сl2, 4 моль СОСl2;
1 моль СО, 1 моль Сl2, 8 моль СОСl2;
2 моль СО, 0.5 моль Сl2, 3 моль СОСl2.
Решение: Запишем выражение для константы равновесия данной реакции: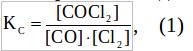
1) Если прореагировало х молей СО и х молей Сl2, то образуется х молей СОСl2 и равновесные концентрации будут равны [CO] = 1–x; [Cl2] = 1–x; [COCl2] = 4+x;
Подставляя равновесные концентрации в уравнение (1), получаем:
соответственно реакция будет идти в сторону образования фосгена.
2) Равновесные концентрации будут равны [CO] = 1–x; [Cl2] = 1–x; [COCl2] = 8+x;
Подставляя равновесные концентрации в уравнение (1), получаем:![]()
соответственно реакция будет идти в сторону разложения фосгена.
3) Равновесные концентрации будут равны [CO] = 2–x; [Cl2] = 0.5–x; [COCl2] = 3+x;
Подставляя равновесные концентрации в уравнение (1), получаем:
соответственно равновесие реакции не сместится.