Химия. 9 класс
Задание 1. В результате термического разложения 302,873 г нитрата металла I группы таблицы Менделеева выделилось 290,83 л (t=50ºC, p=2 атм.) газа. Затем этот газ был пропущен через последовательно соединенные склянки со щелочью и кислотой и использован для полного окисления этилового спирта. В результате полного окисления этилового спирта выделилось 2000 кДж теплоты. Нитрат какого металла был подвергнут разложению, если теплота сгорания одного моля этилового спирта (С2Н5ОН) составляет 1366,91 кДж/моль? Обоснуйте уравнение разложения металла, исходя из его положения в таблице Менделеева.
Решение: 1) Определим объем кислорода, пошедшего на полное окисление этилового спирта:
С2Н5ОН + 3О2 → 2СО2 + 3Н2О + Q (1)
Здесь ты найдешь уроки, исследования, интересные факты и вдохновение для творчества.
3 моль · 22,4 л/моль 1366,91 кДж/моль
х л 2000 кДж/моль
Отсюда, х = 98,324 л (4,389 моль).
2) С использованием газовых законов, приведем объем выделившегося при разложении нитрата металла газа к нормальным условиям (p=1 атм, t=0ºC). Для этого запишем:
(p1 · V1)/T1 = (p2 · V2)/T2, (2) откуда
V2 = (p1·V1·T2)/(T1·p2)= (2 · 290,83 · 273)/(323 · 1) = 491,620 л
3) Поскольку в результате разложения нитратов наряду с О2 выделяется NO2 (что подтверждается данными задачи о поглощении части газа раствором щелочи), объем выделившегося NO2 составил 491,620 л – 98,324 л = 393,296 л (17,558 моль). Отношение числа молей NO2 и О2 в газовой смеси составило 4:1. Полученный результат удовлетворяет стехиометрии разложения нитратов металлов I-ой группы таблицы Менделеева:
4MeNO3 → 2Me2O + 4NO2 + O2 (в случае, если Me одновалентен), (3)
и
2Me(NO3)2→2MeO + 4NO2 + O2 (в случае, если Me двухвалентен (Cu)). (4)
Расчет по уравнению (3) молекулярной массы M(Me)=(y + 62) нитрата показал, что Ar(Me)=7 г/моль, что соответствует элементу литию.
Если расчет провести по уравнению (4), то значение Ar(Me)=-55 г/моль, что не имеет смысла.
Таким образом, термическому разложению подвергнут нитрат лития (LiNO3).
4) В отличие от нитратов других щелочных металлов (Na, K и др.), которые при термическом разложении распадаются до нитритов, нитрат лития является исключением. Дело в том, что по своим химическим свойствам литий напоминает магний (диагональное сходство элементов), который также разлагается до оксида (MgO), NO2 и О2.
Ответ: нитрат лития (LiNO3).
Задание 2. Навеску фосфора сожгли в избытке кислорода. Продукт реакции растворили в воде, раствор нейтрализовали аммиаком, а затем добавили избыток ацетата кальция. Масса осадка составила 15,5 г. Определите массу навески фосфора.
Решение: Составим уравнения реакций:
4P + 5O2 → 2P2O5 (или P4O10);
P2O5 + H2O → 2H3PO4;
H3PO4 + 3NH3 → (NH4)3PO4;
2(NH4)3PO4 + 3Ca(CH3COO)2 → Ca3(PO4)2 + 6CH3COONH4.
Определим число молей фосфора:
n[Ca3(PO4)2] → 2n[(NH4)3PO4] → 2n[H3PO4] → n[P2O5] → 2n[P].
Количество Ca3(PO4)2 составляет 15,5 (г) / 310 (г/моль) = 0,05 моль, откуда число молей фосфора составляет 2·0,05 моль = 0,1 моль.
Таким образом, навеска фосфора составляет 31·0,1 = 3,1 г.
Ответ: m(P)=3,1 г.
Задание 3. Какие химические реакции можно осуществить, имея алюминий, серную кислоту и гидроксид натрия, а также продукты их взаимодействия?
Решение: Уравнения возможных химических реакций:
Задание 4. Сосуд заполнили сухим хлороводородом при нормальных условиях. Затем горло сосуда опустили в воду и вода по мере растворения хлороводорода заполнила целиком сосуд. Вычислить процентную концентрацию полученного раствора соляной кислоты? На сколько процентов изменится концентрация раствора, если хлороводород заменить на фтороводород?
Решение:
Обозначим объем сосуда с хлороводородом V (л). В сосуде объемом V (л) при нормальных условиях будет находиться 36,5·(V/22,4) г HCl.
Масса воды, заполнившей сосуд составляет 1000·V г, которая рассчитывается с учетом плотности воды, равной 1000 в г/л (обращаем внимание на размерность плотности). При этом следует пренебречь объемом HCl, перешедшего из газовой фазы в раствор.
Таким образом, масса всего раствора составляет: 1000·V + 36,5·(V/22,4).
Процентная концентрация может быть рассчитана по формуле:
ω (%) = (m(HCl)/m(раствора))·100%.
После подстановки, получаем:
ω (%) = (36,5·(V/22,4)/(36,5·(V/22,4) + 1000·V))·100%,
ω(HCl) = 0,163 %
Если HCl заменить на HF (М=20 г/моль), то после подстановки в приведенные выше формулы получаем ω(HF) = 0,089 %.
Ответ: ωHCl) = 0,163 %; ω(HF) = 0,089 %.
Задание 5. Из 31 г фосфата кальция количественно выделена фосфорная кислота по реакции с 55,8 мл 70%-ного раствора азотной кислоты (p=1,42 г/см³). Затем раствор нейтрализован 95,3 мл 20%-ного раствора гидроксида натрия (p=1,225 г/см³). Определите массы солей в растворе.
Решение: 1) Определим общую массу азотной кислоты m(HNO3) ![]()
2) Запишем реакцию взаимодействия фосфата кальция и азотной кислоты и по ней определим массу азотной кислоты, вступившей в реакцию m1(HNO3) массу образовавшегося нитрата кальция (m(Ca(NO3)2)) и фосфорной кислоты (m(H3PO4)), учитывая, что азотная кислота взята в избытке: 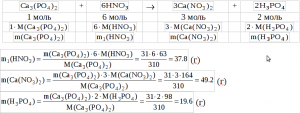
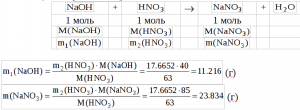
3) Определим массу азотной кислоты, не вступившей в реакцию с фосфатом кальция m2(HNO3);
m2(HNO3) = m(HNO3) — m1(HNO3) = 55.4652 — 37.8 = 17.6652 (г)
4) Определим общую массу взятого гидроксида натрия m(NaOH):
5) Рассчитаем по уравнению реакции между азотной кислотой и гидроксидом натрия массу образовавшегося нитрата натрия (m(NaNO3) и массу прореагировавшей щелочи (m1(NaOH))
6) Определим массу щелочи пошедшую на реакцию с фосфорной кислотой (m2(NaOH)):
m2(NaOH) = m(NaOH) — m1(NaOH) = 23.35 — 11.216 = 12.134 (г)
7) Определим количество молей оставшегося гидроксида натрия и фосфорной кислоты: 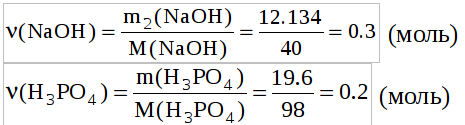
Число молей щелочи в 1.5 раза больше чем фосфорной кислоты, поэтому в результате их взаимодействия должны образовываться 2 кислые соли фосфорной кислоты (гидрофосфат натрия (Na2HPO4) и дигидрофосфат натрия (NaH2PO4)
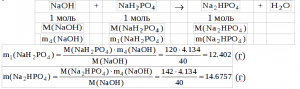
8) Определим массу образовавшегося дигидрофосфата натрия (m(NaH2PO4)) и массу прореагировавшего гидроксида натрия (m3(NaOH)): 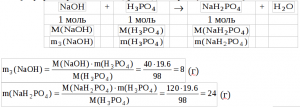 9) Определим массу оставшегося в избытке гидроксида натрия (m4(NaOH)):
9) Определим массу оставшегося в избытке гидроксида натрия (m4(NaOH)):
(m4(NaOH)) = m2(NaOH) — m3(NaOH) = 12.134 — 8 = 4.134 (г)
10) Запишем реакцию взаимодействия дигидрофосфата натрия и щелочи. Определим по ней массу образовавшегося гидрофосфата натрия (m(Na2PO4)) и прореагировавшего дигидрофосфата натрия (m1(NaH2PO4)), поскольку в этой реакции в избытке оказывается уже дигидрофосфат натрия:
11) Определим массу не прореагировавшего дигидрофосфата натрия (m2(NaH2PO4)),
m2(NaH2PO4) = m2(NaH2PO4) — m1(NaH2PO4) = 24 — 12.402 = 11.598 (г)
Ответ: m(Ca(NO3)2) = 49.2 г; m(NaNO3) = 23.834 г; m(NaH2PO4) = 11.598 г; m(Na2HPO4) = 14.6757 г.
Задание 6. Вычислите массу навески вещества, содержащего хром, чтобы масса полученного из нее оксида хрома (III), умноженная на 200, численно равнялась бы массовой доле хрома в исследуемом образце.
Решение: Хром, содержащийся в навеске исследуемого вещества, количественно перевели в Cr2O3. Исходя из этого условия, составим пропорцию: 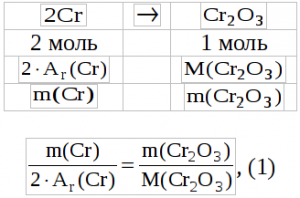
Запишем формулу для расчета массовой доли: 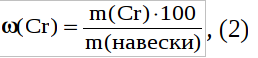
Из уравнения (2) выразим m(Cr) и подставим в уравнение (1):
Зная из условия задачи, что ω(Cr) = 200 · m(Cr2O3) получаем:![]()
Сокращая в уравнении (4) m(Cr2O3), подставляя M(Cr2O3) = 152 г/моль и Ar(Cr) = 52 г/моль, находим массу навески: ![]()